研究内容
1. がんのフェロトーシス回避機構と新規治療法の開発
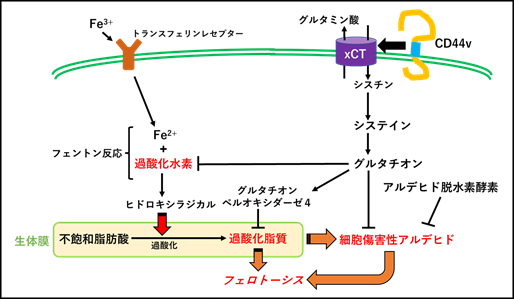
生物は酸素から効率的にエネルギーを獲得するために酸化還元反応を利用していますが、その反応の触媒として鉄イオンを必要とします。生体内および細胞内における鉄イオンや活性酸素種(reactive oxygen species : ROS)レベルは厳密に調節されており、恒常性が維持されていますが、細胞内で常時生成される過酸化水素が鉄イオンと反応すると、脂質酸化力が高いヒドロキシラジカルが生成され、細胞のリン脂質の酸化が生じます。このような脂質の酸化反応は、グルタチオン(GSH)を介した抗酸化システムによって抑制されていますが、酸化還元バランスの破綻が生じた細胞では過酸化脂質の蓄積の結果、フェロトーシス(鉄依存性細胞死)と呼ばれる細胞死が生じます。高い増殖性を示し、正常細胞と比較して多くのエネルギーを必要とするがん細胞ではフェロトーシスを抑制するための抗酸化システムに依存性が高いことから、新たな治療標的として注目されています。
近年、がん以外にも神経変性疾患や心血管疾患などの病態や疾患の進行に酸化還元バランスの破綻によって誘導される細胞死であるフェロトーシスが関与していることが明らかとなってきており、フェロトーシス制御薬の開発を目的とした基礎研究が国内外で広く行われています。これまでに私たちはGSH合成系において重要な役割を果たす分子であり、多くのがん細胞で高発現しているシスチン・グルタミン酸トランスポーターxCTに着目し(図1)、がんにフェロトーシスを効果的に誘導するための標的分子と薬剤の探索を行い、臨床応用を目指した治療法を考案してきました。今後、フェロトーシスが関与する様々な疾患や病態において、さらに各細胞系におけるフェロトーシス制御機構の仕組みや異常が分子レベルで明らかになり、アンメットメディカルニーズに応える画期的な予防薬や治療薬が開発されることが期待されます。(永野修)
2. がん幹細胞の分化制御機構の解明とそれに基づく新規治療法の開発
2-1. アクチン細胞骨格動態による分化制御機構の解明
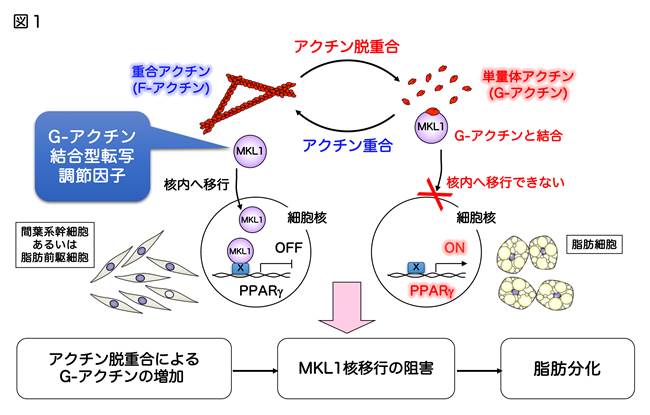
ヒトなどの多細胞生物の体は、形や働きが異なる様々な細胞によって形成されていますが、細胞がこのように特定の形と働きを持つようになることを「分化」と呼びます。細胞分化は種々の転写因子の発現によって誘導されることが知られており、未分化な前駆細胞から成熟した脂肪細胞へと分化する時には、PPARgと呼ばれる転写因子がまず発現します。他方、細胞は分化に伴ってアクチンと呼ばれる細胞の骨組み(アクチン細胞骨格)を組み換え、それぞれの機能に特徴的な形態へと変化することが報告されてきました。そのため、分化シグナルがアクチン細胞骨格を動かして細胞の形を決定しているであろうと漠然と信じられてきました。これまでに私達は、アクチン細胞骨格の動態変化が、MKL1という転写調節因子の核移行および転写活性を負に制御することで、PPARgの発現をONにして、脂肪分化を誘導することを明らかにしてきました(図1;文献1-3)。本研究は、細胞の「かたち」という物理的要素の変化が分化を直接制御するという、これまでの常識を覆す新たな概念であると考えます。現在、脂肪細胞の分化だけでなく、他の細胞種の幹細胞さらには未分化な性質を持つ腫瘍細胞(がん幹細胞)のアクチン動態を変化させることで分化を制御できるか検討するとともに、その分子メカニズムの解明を試みています。
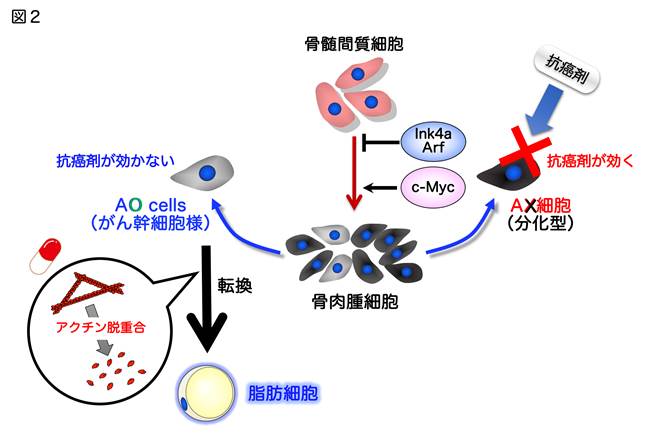
2-2. アクチン動態制御に基づくがん幹細胞の分化転換治療法の開発
私達はこれまでにマウス骨髄間質細胞に癌遺伝子c-MYCの過剰発現および癌抑制遺伝子Ink4a/Arfを欠損することによって、致死性の悪性腫瘍を形成する骨肉腫細胞を樹立しました。また、これら骨肉腫細胞の性状解析を行ったところ、抗癌剤が効く分化型のAX細胞と抗癌剤が効かないがん幹細胞様のAO細胞の2種類の細胞が同定されました(図2;文献4)。さらに私達は、AO細胞のアクチン細胞骨格を薬剤を用いて脱重合(バラバラにする)することで、成熟脂肪細胞へと終末分化が誘導され、腫瘍形成が抑制されることを発見しました(図2;文献4)。現在、これらの成果に基づいて、ヒト骨肉腫幹細胞、さらには他の組織型がん幹細胞において、アクチン動態を薬剤制御することによって、腫瘍形成能力の低い細胞へと分化系譜を転換させて、腫瘍抑制するという新たな治療法(分化転換治療法)の開発を目指しています。(信末博行)
文献1:Nobusue H, Onishi N, Shimizu T, Sugihara E, Oki Y, Sumikawa Y, Chiyoda T, Akashi K, Saya H and Kano K: Regulation of MKL1 via actin cytoskeleton dynamics drives adipocyte differentiation. Nat Commun (2014) 5:3368. doi: 10.1038/ncomms4368.
文献2:信末博行, 加野浩一郎, 佐谷秀行: アクチン動態変化による細胞分化の制御 細胞工学 (2014) 33 (9):961-966.
文献3:Kunitomi H, Oki Y, Onishi N, Kano K, Banno K, Aoki D, Saya H and Nobusue H: The insulin-PI3K-Rac1 axis contributes to terminal adipocyte differentiation through regulation of actin cytoskeleton dynamics. Genes Cells (2020) 25:165-174.
文献4:Takahashi N, Nobusue H, Shimizu T, Sugihara E, Yamaguchi-Iwai S, Onishi N, Kunitomi H, Kuroda T and Saya H: ROCK inhibition induces terminal adipocyte differentiation and suppresses tumorigenesis in chemoresistant osteosarcoma cells. Cancer Res (2019) 79:3088-3099.
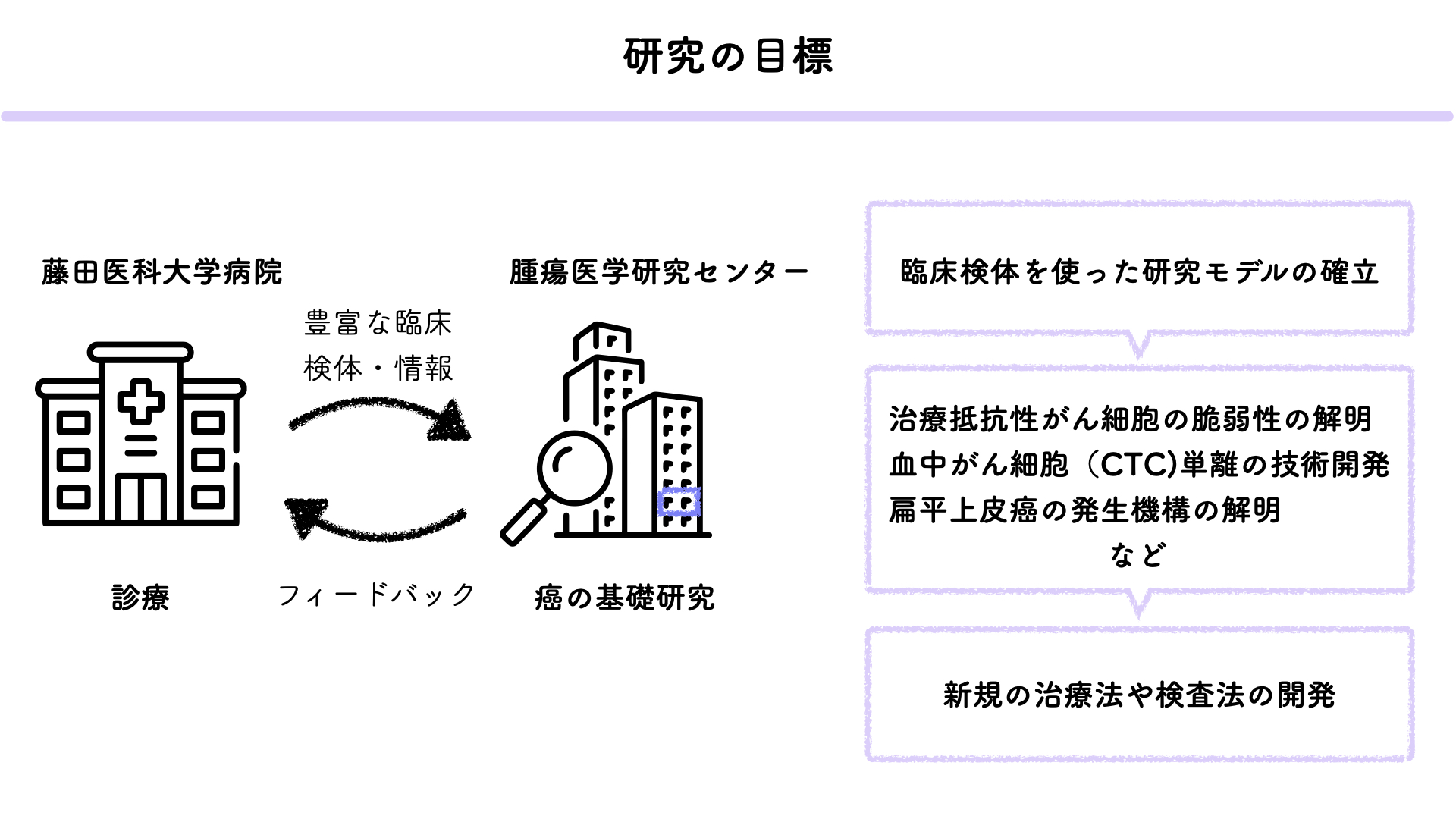
3. がん患者由来検体を用いた研究プラットフォームの構築
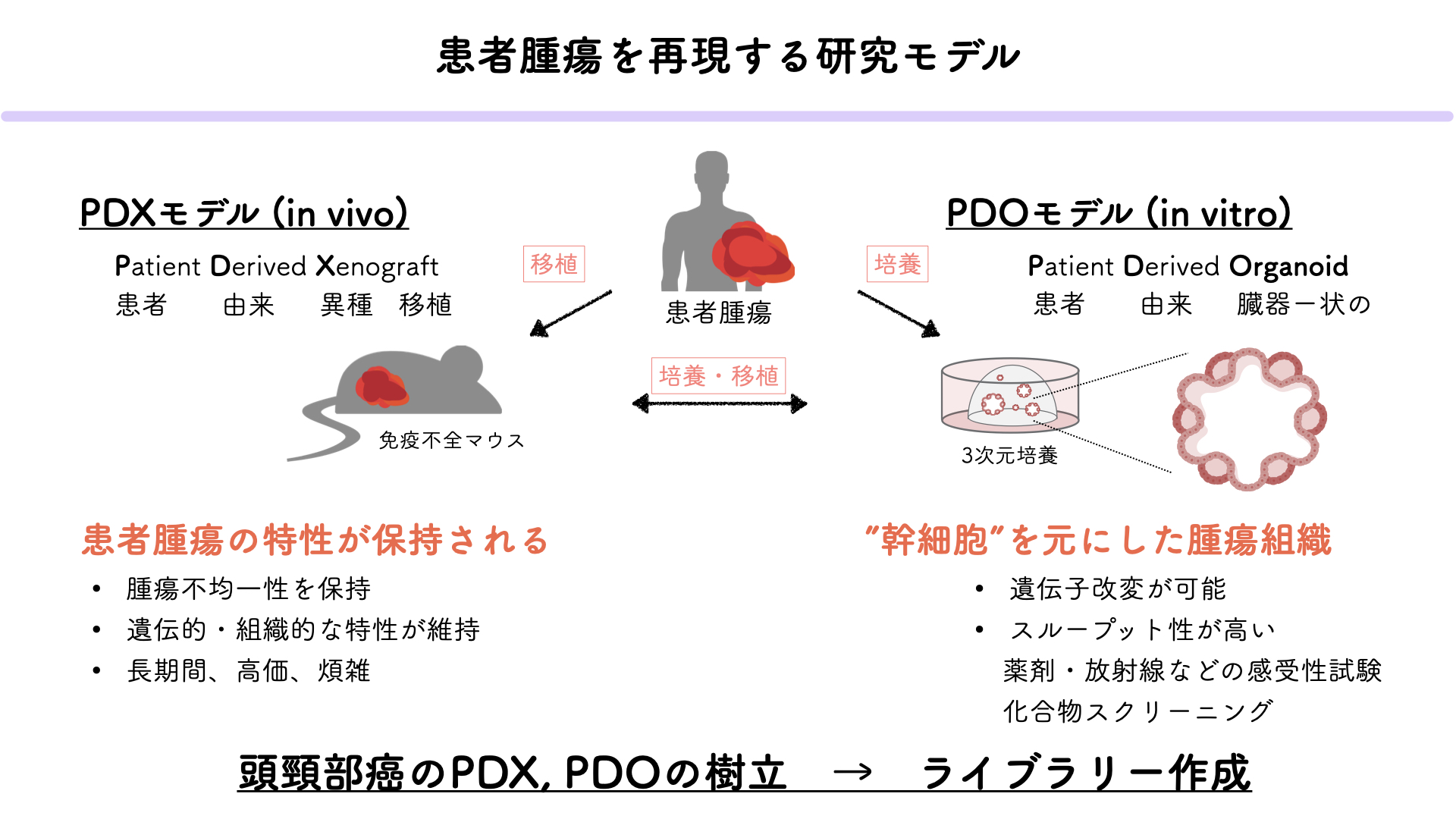
患者由来異種移植(PDX)モデルは、患者から直接採取したがん組織を免疫不全マウスに移植することで、患者特有の腫瘍微小環境と遺伝的特徴を保持した状態でがんを研究することを可能にします。これにより、個々の患者に対する治療法の効果をより正確に評価でき、臨床的意義の高いデータを得ることができます。当研究室では、藤田医科大学病院の頭頸部外科から提供される手術検体を用いてPDXモデルを樹立し、新たな治療薬の開発とがんの個別化医療への応用を目指しています。さらに、患者やPDXモデルから得られた腫瘍組織を用いてオルガノイドを樹立しています。オルガノイドは、がん細胞が三次元構造を形成し、より生理的環境に近い状態での成長を可能にします。これにより、個々のがんの特性を維持したまま薬剤感受性試験を行うことができます。オルガノイドを用いた試験は、従来の二次元培養法に比べてより実臨床に即した薬剤応答を評価できるため、新しい治療法の開発や既存治療法の最適化に非常に有用です。当研究室では、PDXモデルおよびオルガノイドから得られたデータを基に、臨床情報が紐づいたPDXライブラリーおよびオルガノイドライブラリーを構築しています。これらのライブラリーは、多様ながんの遺伝的特性および表現型を包括的に解析し、それぞれの腫瘍の挙動や薬剤感受性についての詳細な情報を得ることができます。実際の患者の腫瘍組織を使用することで、研究結果の臨床への応用がよりスムーズに進むことが期待され、新しい治療薬のスクリーニングと個別化医療の実現に貢献することが期待されます。(渡辺崇)
4. がん細胞特異的スプライシング制御因子の機能解析
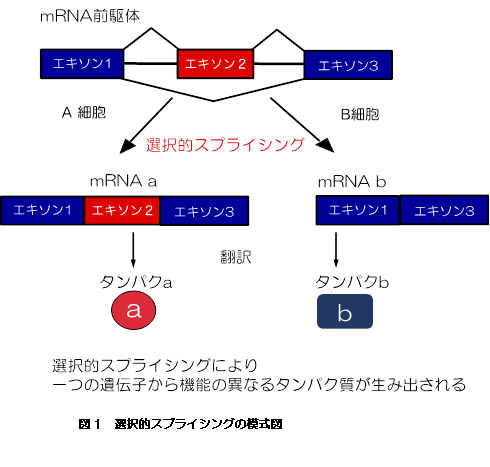
ヒトを含めた高等真核生物において、長大なイントロンに分断された小さなエキソンを認識し、正確にイントロンを取り除くmRNA前駆体スプライシング(以下スプライシング)は、正常な遺伝子発現に必須である。加えて発生段階、組織特異的、細胞環境などに応答して特定のエキソンを選び出し、1つの遺伝子から多種類のタンパク質を作り出す(図1)。つまり、選択的スプライシングは、生命の高次性を生み出す重要な原動力となっている。実際、ヒトの全遺伝子は2万2千程度と見積もられているが、9割以上の遺伝子が何らかの選択的スプライシングを受けており、12万種類以上のタンパク質が生み出されていると推測されている[Lee et al., Annu Rev Biochem 84, 291-323(2015)]。
このように選択的スプライシングは、1つの遺伝子から多くの情報を引き出すことができる素晴らしい遺伝子発現機構ではあるが、その複雑性ゆえに破綻すると、がんや遺伝性疾患の原因となる[Scotti et al., Nat. Rev. Genet., 17, 19-32 (2016)]。例えば、様々な癌細胞でスプライシング因子(SF3B1, SRSF2, U2AF35, ZRSR2)をコードする遺伝子における体細胞変異と、それに伴う異常な選択的スプライシングが報告されている。スプライソソーム構成因子の体細胞変異は、骨髄異形成症候群や慢性リンパ性白血病など血液悪性腫瘍で初めて報告されたが、その後、様々な固形腫瘍でも報告されている。その変異は悪性黒色腫の15–20%、膵管腺癌の4%、肺腺癌の3%、そして乳癌の1.8%の割合を占める[Dvinge H et al, Nat. Rev. Cancer., 16, 413–430, (2016) ]。本研究室では、がん細胞特異的なスプライシング制御因子の異常と抗がん剤耐性機構に着目し、研究を行っている。(福村和宏)
5.次世代シーケンサーやロングリードシーケンサーを駆使した難治性がんに対する有効な治療法と検出法の開発
5-1.難治性がんに特異的な生物学的特徴の解明と治療法開発
がん細胞は正常の細胞と異なり、ゲノムDNAに必ず変異を持っている疾患です。そのため、次世代シーケンサー等を駆使し、がん細胞特有の遺伝子変異、ゲノム構造異常、遺伝子発現プロファイリングに基づいて、特に有効な治療法がない難治性がんや再発したがんの生物学的特徴や特性の解明を目指した研究を行っています。また、分子標的薬を用いた薬剤スクリーングや私達が構築してきた様々な発がんマウスモデル(文献1, 2)、臨床検体を用いた解析により、実際の臨床での治療を見据えた研究を進めています。これらの研究により、副作用の少ないがんに特化した有効な治療法の開発が期待されます(図1)。(杉原英志)
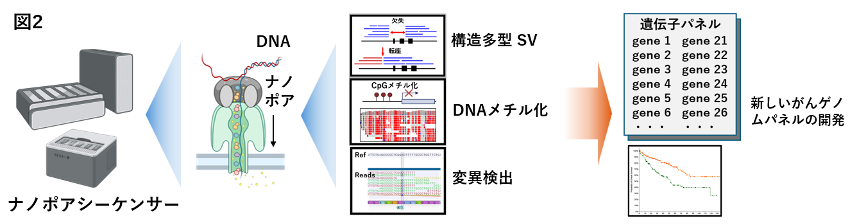
5-2.ロングリードシーケンス解析によるがんゲノム構造異常やメチル化領域異常の検出と次世代型がんゲノムパネルの構築
私達は2021年より藤田医科大学で約160個のがん関連遺伝子を解析するがんゲノムパネル検査を実装し、これまで2,000例近くの解析を実施してきました (文献3)。現在、ショートリードシーケンサーによる遺伝子変異解析やコピー数異常検出に加えて、ナノメートルのサイズの穴にDNA塩基を通して解析するナノポアシーケンサーを用いたロングリードシーケンス解析を進めています (文献4)。これまで解析が困難であった数万~数百万塩基の大型ゲノム構造解析による新たながん関連遺伝子異常の検出とメチル化解析を行っています。今後、がん患者の予後診断や層別化が可能なこれまでにない、次世代型がんゲノムパネルの構築を目指して開発を進めていきます(図2)。(杉原英志)
文献1: Sugihara E, Hashimoto N, Osuka S, Shimizu T, Ueno S, Okazaki S, Yaguchi T, Kawakami Y, Kosaki K, Sato TA, Okamoto S, Saya H. The Inhibitor of Apoptosis Protein Livin Confers Resistance to Fas-Mediated Immune Cytotoxicity in Refractory Lymphoma. Cancer Res. 2020 Oct 15;80(20):4439-4450.
文献2: Ueno S, Sudo T, Saya H, Sugihara E. Pigment epithelium-derived factor promotes peritoneal dissemination of ovarian cancer through induction of immunosuppressive macrophages. Commun Biol. (2022) Sep 2;5(1):904.
文献3: Chikaishi Y, Matsuoka H, Sugihara E, Takeda M, Sumitomo M, Yamada S, Inaguma G, Omura Y, Yeongcheol C, Kobayashi Y, Nakauchi M, Hiro J, Masumori K, Otsuka K, Nishihara H, Suda K, Saya H, Takimoto T. Mutation Analysis of TMB-High Colorectal Cancer: Insights Into Molecular Pathways and Clinical Implications. Cancer Sci. (2025) Nov;29(11):1746-1755.
文献4: Mariya T, Kato T, Sugimoto T, Miyai S, Inagaki H, Ohye T, Sugihara E, Muramatsu Y, Mizuno S, Kurahashi H. Target enrichment long-read sequencing with adaptive sampling can determine the structure of the small supernumerary marker chromosomes. J Hum Genet. 2022 Jun;67(6):363-368.